宋冠林,王安琪,路来风, ,张 浩,李守辉,王昌禄,
(1.天津科技大学食品科学与工程学院,天津 300457;
2.食品营养与安全国家重点实验室,天津 300457)
随着农业现代化进程的推进,农业生产(加工)产生的固体废物(主要组分为纤维素、蛋白质、淀粉等[1-2])已造成严重的农业面源污染.在肥料资源化过程中,单菌株发酵物料常出现营养分解利用不充分、腐熟不彻底等问题,而复合功能微生物中的酶类可协同作用于目标物质[3].市售的复合微生物菌剂主要为粉剂和粒剂[4],具有易分散、运输稳定性好等优势,但酶活性较低;
市售的高酶活块状复合菌剂较少.
目前,国内已报道固体复合菌剂中温(37℃)产羧甲基纤维素(CMC)酶的酶活力最高为 5289U/g[5].王勇[6]构建了三元混合真菌复合腐熟剂,产纤维素酶的酶活力为 75.36U/g.有研究[7]表明,嗜冷菌对堆肥升温有较好效果,且有更高酶活力的蛋白酶.彭宇等[8]以酶活力为 80U/g的中性蛋白酶菌剂 B生产甘蔗有机肥,可以明显提高有机肥中的营养指标及有效活菌含量.罗立津等[9]在耐低温木质纤维素降解菌群A25-3的基础上补充酿酒酵母和绿色木霉制成固体复合菌剂,α-淀粉酶的酶活力为47.89U/g,可以有效提高堆肥体系的温度,高效降解秸秆.为提高菌剂水解酶类酶活力、降低成本、延长菌剂保存时间,本研究以实验室专利菌株白黄链霉菌(Streptomyces alboflavus)TD-1与前期筛选出的优势菌构建复合微生物体系,优化发酵条件和多元辅料配比,得到酶活力较高的固态基质,并在发酵前后合理补充助剂,经 5L发酵罐放大,旨在建立一种新型水分散性生物有机肥发酵菌剂的制备工艺,为进行规模化堆肥提供一种可靠的生物有机肥发酵菌剂.
1.1 材料
1.1.1 菌种与原料
白黄链霉菌(Streptomyces alboflavus)TD-1、枯草芽孢杆菌(Bacillus subtilis)KC1、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)SY07、乳酸杆菌(Lactobacillus)RS1、绿色木霉(Trichoderma viride)LM1均为实验室保藏菌株.耐高温蛋白分解菌 F19,从纳米膜发酵鸡粪有机肥中分离筛选.耐高温纤维素分解菌 XWS2、硝化细菌 XN1、亚硝化细菌 YN3、硫化氢分解菌 HS1、硫化氢分解菌 HS2均从鸡粪条垛堆肥中分离筛选,酿酒酵母(Saccharomyces cerevisiae)NJ1从安琪酿酒酵母粉中分离筛选.
麦麸、豆粕、稻壳,商丘马培中食品有限公司;
菌糠,天津市某食用菌公司;
糠醛渣,日照苔上海洋生物科技有限公司;
强兴堆肥发酵菌剂,河南恒信农化有限公司.
1.1.2 试剂与仪器
3,5-二硝基水杨酸(DNS),天津百奥泰科技发展有限公司;
三聚磷酸钠(STPP)、木质素磺酸钠(CLF),天津市江天化工科技有限公司;
羧甲基纤维素,天津市百世化工有限公司;
酪蛋白、十二烷基硫酸钠(SDS)、聚乙二醇 6000(PEG6000)、十二烷基苯磺酸钠(SDBS)、糊精,北京索莱宝公司;
海藻酸钠(SA),上海麦克林试剂公司;
丙三醇、吐温 80,天津康科德科技有限公司;
其他常用试剂均为国产分析纯试剂.
Allegra X-30型台式高速离心机,美国Beckman公司;
Infinite M200 PRO 型酶标仪,瑞士 Tecan公司;
Seven Easy型酸度计,梅特勒-托利多仪器(上海)有限公司.
1.1.3 培养基
乳粉培养基(g/L):牛肉膏 5,蛋白胨 10,NaCl 5,脱脂乳粉 30,pH 7.0~7.2.
H2S选择培养基(g/L):葡萄糖5.0,K2HPO40.5,KNO31.0,MgCl20.5,NaCl 0.5,NH4Cl 0.5,Na2CO31.0,FeCl20.01.在盛有50mL该培养基的250mL三角瓶中放置 1个 10mL离心管,离心管中加入 3mL 25% H2SO4和1g FeS,用于产生H2S.
无机盐培养基(g/L):KH2PO41.0,NaCl 0.5,MgSO40.5,CaCl20.1,FeSO40.01,CoCl20.01.
以上培养基灭菌条件为121℃灭菌20min.
1.2 实验方法
1.2.1 多元辅料固态发酵基质的筛选
选取麦麸、菌糠、糠醛渣、稻糠(稻壳)、豆粕共 5种辅料,粉碎后以碳源与氮源质量比为 1:1、碳氮比(C/N)为25设计基质配比(表1).

表1 固态发酵基质配制方案Tab.1 Program for solid-state fermentation substrate preparation
将 100g基质置于 500mL三角瓶中,添加无机盐培养基,调节含水率为 40%~50%,121℃灭菌20min.将菌种活化后转接至各自的种子培养基中:XWS2、F19、XN1、YN3、HS1、HS2、KC1、SY07 转接至 LB 培养基[10],LM1转接至 PDB 培养基[11],NJ1转接至麦芽汁培养基[12],RS1转接至乳粉培养基,TD-1转接至链霉菌 TD-1种子液培养基[11].菌株培养至对数期的 80%[13],通过前期拮抗实验,确定菌悬液比例为 NJ1:SY07:TD-1:XWS2:F19:XN1:YN3:HS1:HS2:LM1:KC1:RS1=3:3:1:1:1:1:1:1:1:1:1:1,混合后得到混合菌液.将混合菌液以 10%的接种量接种至发酵基质上,30℃发酵 7d,每天翻拌 1次,防止结块,测定 CMC酶、中性蛋白酶、α-淀粉酶的酶活力.
1.2.2 固态发酵基质C/N的确定
将筛选得到的高酶活固态发酵基质物料以 C/N为 15、20、25、30、35重新调整比例发酵.测定 CMC酶、中性蛋白酶、α-淀粉酶的酶活力.
1.2.3 固态发酵条件优化
在固态发酵基质基础上,依据前期发酵条件单因素实验结果,确定各因素实验区间,参照L16(45)正交表调整发酵参数,设置初始 pH(5、6、7、8)、培养温度(25、30、35、40℃)、培养时间(5、7、9、11d)、接种量(5%、10%、15%、20%)、初始含水率(40%、50%、60%、70%)进行正交实验优化固态发酵条件.
1.2.4 水分散性助剂筛选及用量的确定
将质量分数为 3%的润湿剂(SDS、PEG6000、SDBS)添加至最佳发酵产物上,加水混匀后装入柱状模具中压紧,在鼓风干燥烘箱中 40℃风干至含水率为 15%,按照国家标准(GB/T 1600—2001)进行水分测定和监控;
再经高速粉碎机破碎成粉,按照国家标准(GB/T 5451—2001)测定润湿时间.调整润湿剂添加量(1%、3%、5%),确定润湿剂种类和用量.
在含有润湿剂的发酵产物上,添加分散剂(CMC、CLF、STPP),方法同润湿剂的实验方法,按照国家标准(GB/T 14825—2006)测定悬浮率,确定分散剂的种类及用量.
在含有润湿剂、分散剂的发酵产物上,添加崩解剂〔CaCl2、(NH4)2SO4、SA〕,方法同润湿剂的实验方法,崩解指标分散次数的测定采用量筒混合法[14],确定崩解剂的种类及用量.
在含有润湿剂、分散剂、崩解剂的发酵产物上添加保护剂(丙三醇、吐温 80、糊精),方法同润湿剂的实验方法,确定保护剂的种类和用量.
1.2.5 非离子表面活性助剂对菌剂发酵的影响
非离子表面活性助剂可以提高菌剂的发酵产酶活性,将 3% PEG6000、5%吐温 80在发酵前加入,5% STPP、5%(NH4)2SO4在发酵后加入,分别在发酵第5天和第7天取样烘干成型,测定3种水解酶的酶活力、水分散性指标.分别采用锌氨络盐吸收比色法[15]和靛酚蓝分光光度法[16]测定菌剂的 H2S去除率和NH3去除率.
1.2.6 生物有机肥发酵菌剂制备工艺的放大
放大发酵前使用 75%乙醇对自制 5L发酵罐擦拭消毒,罐口覆 8层纱布.将装料量由 100g/500mL放大为 1kg/5L,放大后的基质不进行灭菌处理.将发酵好的菌剂置于 1.5L泡沫箱中,碾压成块状,其他发酵条件同 1.2.3节中最佳发酵条件、助剂添加时间与添加量同1.2.5节,将500mL三角瓶与5L发酵罐发酵的实验效果进行比较.按照标准 NY/T 798—2004《复合微生物肥料》中稀释涂布平板法测定有效活菌数,按照标准 GB 20287—2006《农用微生物菌剂》测定pH.
1.2.7 生物有机肥发酵菌剂贮藏稳定性的测定
将生物有机肥发酵菌剂在 20~25℃密封贮存30d,检测菌剂中的有效活菌数、水解酶的酶活力及除臭性能,评估生物有机肥发酵菌剂的贮藏稳定性.
1.2.8 生物有机肥发酵菌剂的豆粕堆肥效果验证
采用豆粕复配辅料稻壳粉、菌糠、香蕉皮粉进行豆粕堆肥,调整 C/N 为 25:1,即 600g豆粕、150g菌糠、150g稻壳粉、9g香蕉皮粉.称取909g混合物料装入3L底部开孔的泡沫箱中,加入适量水将堆肥物料润湿,按质量比0.5%添加各类菌剂.实验组先将生物有机肥发酵菌剂溶于水中制成质量分数为0.99%的悬浮液,然后倒入堆肥物料中;
对照组与空白组分别为向堆肥物料中直接撒入商业强兴堆肥发酵菌剂菌粉与生物有机肥发酵菌剂未发酵基质,调整含水率至60%,翻拌均匀,静置发酵.
采用人工翻堆供氧,覆扎孔塑料薄膜保温,将其置于 30℃恒温培养箱中,发酵高温期(50℃)前每2d翻堆 1次,进入高温期后待温度下降即翻堆,使高温期维持10d左右,揭膜覆盖8层纱布,在发酵第40天测定堆肥品质,按标准 NY/T 525—2021《有机肥料》评价该生物有机肥发酵菌剂发酵效果.
1.3 水解酶类活性测定方法
1.3.1 CMC酶的酶活力测定
称取10.0g固体菌剂,加入装有100mL蒸馏水和玻璃珠的 500mL三角瓶中,静置 20min,180r/min振荡 30min,4000r/min离心 10min,上清液即为粗酶液,采用DNS法测定CMC酶[17]的酶活力.
1.3.2 中性蛋白酶的酶活力测定
参照 GB/T 23527—2009《蛋白酶制剂》中福林酚法测定中性蛋白酶的酶活力.
1.3.3α-淀粉酶的酶活力测定
称取 1.0g固体菌剂置于研钵中,加入少量二氧化硅和 2mL蒸馏水,研磨匀浆.将匀浆倒入离心管中,用 6mL蒸馏水分次将残渣清洗并转入离心管.提取液在室温下静置提取 15min,每隔 2min搅动 1次;
4000r/min离心 10min,将上清液倒入100mL容量瓶中,加蒸馏水定容至刻度,摇匀,即为淀粉酶原液.采用DNS法测定α-淀粉酶[18]的酶活力.
1.4 菌剂其他指标测定方法
1.4.1 除臭性能计算
考虑到菌剂可能在发酵过程中产生不良气体,设置 2个空白对照组,命名为 CK1、CK2.CK1为在NH3选择培养基[19]与 H2S选择培养基中不添加菌剂、添加外源臭味气体组,CK2为在上述两种培养基中添加菌剂、不添加外源臭味气体组.实验组为上述两种培养基中添加菌剂和外源臭味气体组.按照式(1)和式(2)分别计算 NH3去除率(1r)和 H2S去除率(r2).

式中:G1、G2、G3分别为 CK1组、实验组、CK2组NH3释放量,mg/L;
G4、G5、G6分别为 CK1 组、实验组、CK2组H2S释放量,mg/L.
1.4.2 有效活菌数及存活率计算
按照式(3)和式(4)分别计算有效活菌数(nm)和贮藏后有效菌存活率(r).


式中:n、n1分别为贮藏 30d前后菌剂的有效活菌数,g-1.
1.4.3 电导率的测定
将豆粕堆肥样品与去离子水按质量体积比 1:10混合,30℃、180r/min振荡 30min,10000r/min离心 10min,用 0.45µm 滤膜过滤.用电导率仪测定上清液的电导率(σ).
1.4.4 终点C/N:初始C/N的测定
总碳(TOC)含量=有机质含量/1.732.总氮(TN)含量按照 H2SO4消解凯氏定氮法测定.有机质含量参照NY/T 525—2021《有机肥料》中重铬酸钾容量法测定.
1.4.5 种子发芽指数的测定
种子发芽指数(GI)按照标准 NY/T 525—2021《有机肥料》测定.
1.5 数据处理与分析
运用 SPSS 22.0进行单因素方差分析(one-way ANOVA),结合邓肯(Duncan)氏法进行差异显著性检验,结果与分析表中数据同列不同字母表示差异显著(P<0.05).
2.1 生物有机肥发酵菌剂固态发酵基质的筛选
固态发酵基质水解酶的酶活力测定结果见表2.
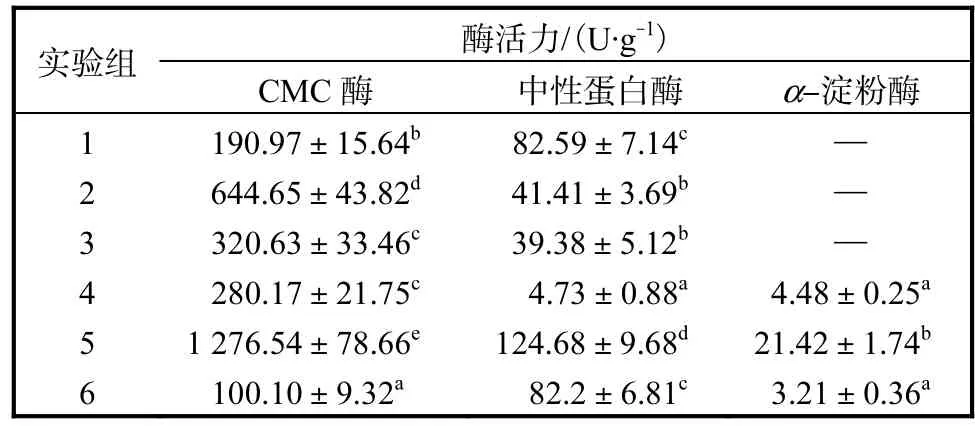
表2 固态发酵基质水解酶的酶活力Tab.2 Enzyme activity of solid-state fermentation substrate hydrolase
含有糠醛渣与菌糠的组合水解酶的酶活力较低.虽然糠醛渣含有大量有机质[20],可供给微生物生长所需营养,但其微孔结构中酸度过大[21],会抑制微生物的生长;
菌糠为食用菌培养基残渣,其粗纤维等组分已降解和转化[22],不足以提供微生物代谢所需养分.因此,选用麦麸和稻糠为碳源,豆粕为氮源作为固态发酵基质.
2.2 固态发酵基质C/N的确定
麦麸、稻糠、豆粕发酵基质比例见表3.

表3 麦麸、稻糠、豆粕发酵基质比例Tab.3 Fermentation substrate ratio of wheat bran,rice bran and soybean meal
不同 C/N下固态发酵基质水解酶的酶活力结果见表4.当初始C/N为25时,CMC酶和中性蛋白酶的酶活力均处于最低水平;
C/N为 20时,CMC酶和α-淀粉酶的酶活力最高;
C/N 为 30时,中性蛋白酶的酶活力最高.综合考虑,选取C/N为20.

表4 不同C/N下固态发酵基质水解酶的酶活力Tab.4 Enzyme activity of solid-state fermentation substrate hydrolase under different C/N
2.3 固态发酵条件正交优化
根据单因素实验结果,以水解酶的酶活力为指标,优化初始 pH(A)、培养温度(B)、培养时间(C)、接种量(D)、含水率(E)发酵条件,结果见表5.
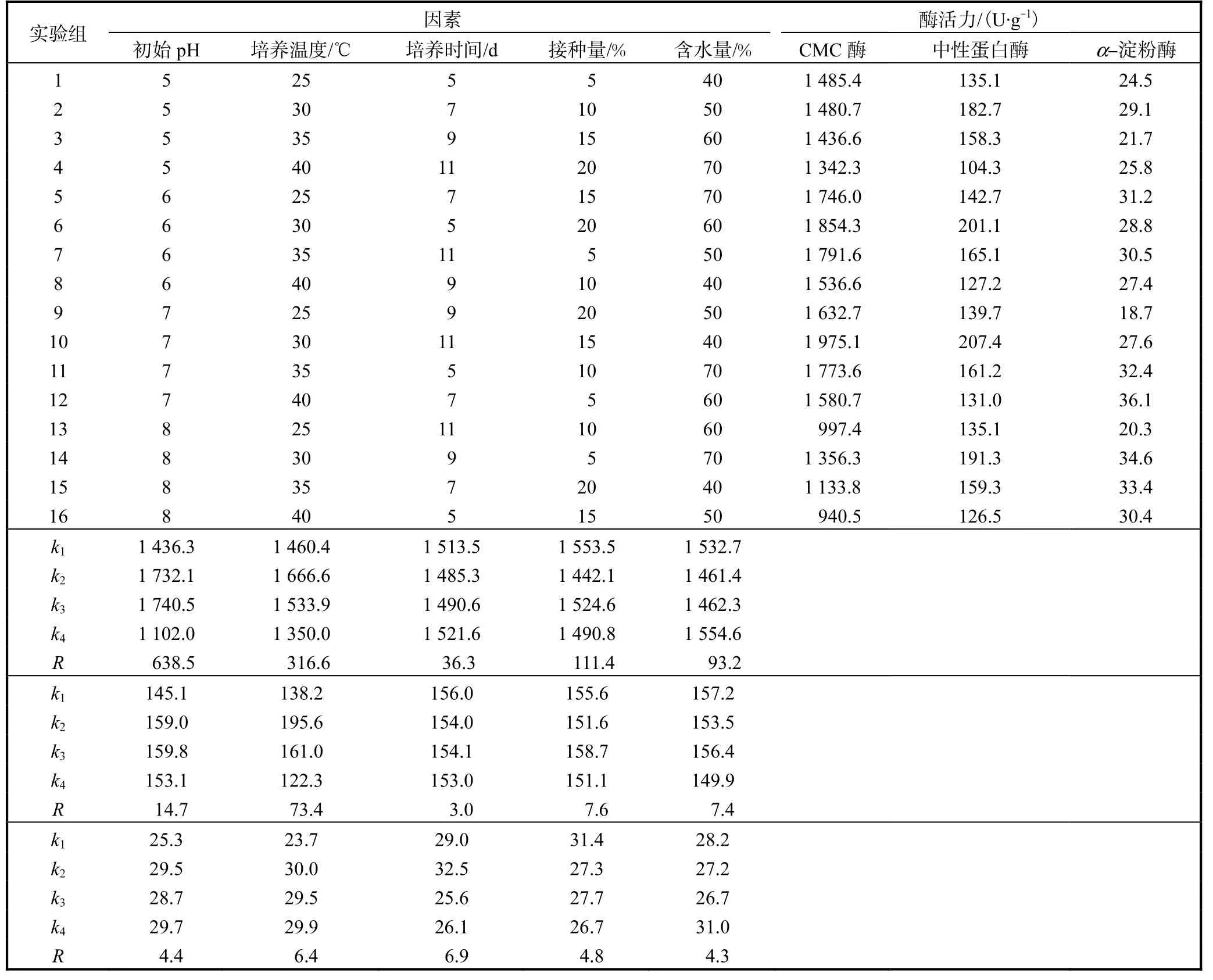
表5 固态发酵条件正交优化Tab.5 Orthogonal optimization of solid-state fermentation conditions
产 CMC酶、中性蛋白酶、α-淀粉酶的最佳发酵条件分别为 A3B2C4D1E4、A3B2C1D3E1、A4B2C2D1E4.综合考虑,确定最佳发酵条件为方案 A3B2C2D1E1,即:初始pH 7.0、培养温度30℃、培养时间7d、接种量5%、含水率40%.以上述条件进行验证,CMC酶、中性蛋白酶、α-淀粉酶的酶活力分别为 1878.6、203.8、37.0U/g,说明方法稳定可行.
2.4 水分散性助剂的筛选
对固态发酵基质的润湿剂、分散剂、崩解剂进行筛选,结果如图1所示.
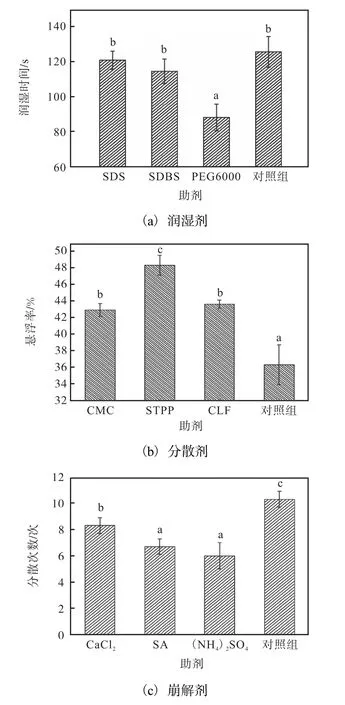
图1 固态发酵基质的润湿剂、分散剂、崩解剂的筛选Fig.1 Screening of wetting agent,dispersant and disintegrating agent for solid fermentation substrate
润湿时间及悬浮率是衡量分散剂效果的重要指标[23].不同润湿剂类别影响生物有机肥发酵菌剂的润湿时间,润湿时间越短,说明润湿效果越好.图1(a)为添加 3种润湿剂的生物有机肥发酵菌剂的润湿时间.当选取 PEG6000为润湿剂时,生物有机肥发酵菌剂的润湿时间最短.
悬浮率的测定用来确定菌剂的最高喷洒浓度,悬浮率越高则水分散性越高.图1(b)为固态发酵基质添加不同分散剂的悬浮率.分散剂为非离子表面活性剂 STPP时,菌剂悬浮率显著高于各处理组(P<0.05).
分散次数为崩解剂测定指标,即将水中沉积物分散至不可再分散的颠倒次数.图1(c)为菌剂中添加不同崩解剂的分散次数.结果表明,(NH4)2SO4作为崩解剂时分散次数最少,故崩解剂选用(NH4)2SO4.
在 40℃烘干时,测定 3种保护剂(丙三醇、吐温80、糊精)对菌剂水解酶酶活力的保护作用,结果如图2所示.当选用丙三醇时,CMC酶的酶活力达1377.2U/g,CMC酶的酶活力增加量最大;
当选用吐温80时,CMC酶的酶活力与其他两种保护剂相比略低,无显著性差异(P≥0.05),但吐温 80组的中性蛋白酶和α-淀粉酶的酶活力均为最高,与各处理组中性蛋白酶的酶活力和α-淀粉酶的酶活力差异显著(P<0.05).综合考虑,选用非离子表面活性剂吐温80作为保护剂.

图2 固态发酵基质添加不同保护剂的水解酶的酶活力Fig.2 Hydrolytic enzyme activity of solid-state fermentation substrate with different protective agents
2.5 水分散性助剂用量的确定
助剂用量筛选单因素实验结果见表6.由表6可知:助剂选用 3% PEG6000、5%STPP、5%(NH4)2SO4时,水分散性指标最优.虽然需考虑生产成本,但用1% 吐温 80时菌剂的中性蛋白酶的酶活力最高,CMC酶的酶活力与 5%吐温 80相差甚大,故保护剂吐温80的用量为5%.

表6 助剂用量的筛选Tab.6 Screening of the dosage of auxiliaries
2.6 非离子表面活性剂类助剂对菌剂发酵及质量的影响
助剂中 PEG6000和吐温 80为非离子表面活性剂,将这两种助剂在发酵前添加,基质发酵 5d、7d,烘干后的生物有机肥发酵菌剂各指标测定结果见表7.与2.5节中CMC酶的酶活力相比,非离子表面活性剂不能加速基质发酵进程,生物有机肥发酵菌剂发酵7d产水解酶的酶活力显著高于发酵5d(P<0.05).菌剂中H2S分解菌HS1和HS2可有效去除H2S,亚硝化细菌 YN3和硝化细菌 XN1可抑制 NH3的逸出,将其转化固定为离子,发酵 7d对臭味物质 H2S的去除率与发酵 5d相比有显著性差异(P<0.05),两组NH3去除率与水分散性差异不显著(P≥0.05).

表7 非离子表面活性剂类助剂对发酵进程的影响Tab.7 Effects of non-ionic surfactants on fermentation process
发酵前添加非离子表面活性剂(T组)对菌剂质量影响结果见表8.发酵前添加非离子表面活性剂可在一定程度上提高水解酶的酶活力水平,特别是中性蛋白酶的酶活力可达 267.8U/g,与发酵后添加非离子表面活性剂(CK组)相比提高了 95.8%,亦可促进臭味物质 H2S的吸收,但基本不影响生物有机肥发酵菌剂的NH3吸收与其水分散性.

表8 发酵前添加非离子表面活性剂对菌剂质量的影响Tab.8 Effect of adding non-ionic surfactants before fermentation on the quality of microbial agents
2.7 5L发酵罐放大制备生物有机肥发酵菌剂
将原有制备工艺放大,研究放大后指标变化,结果见表9.放大后菌剂水解酶的酶活力、水分散性、除臭效果、有效活菌数均低于三角瓶发酵,5L发酵罐发酵产 CMC酶的酶活力、中性蛋白酶的酶活力、α-淀粉酶的酶活力、H2S去除率、有效活菌数,与500mL三角瓶发酵具有显著性差异(P<0.05).这说明放大发酵不易翻堆与拌匀,造成中心物料发酵不充分,基质未经灭菌,原著微生物同外源微生物发生拮抗作用.菌剂用作水分散剂时,推荐使用量为0.99%,生物有机肥发酵菌剂成品指标均符合国家标准GB 20287—2006《农用微生物菌剂》.

表9 生物有机肥发酵菌剂放大发酵后指标变化Tab.9 Index changes of fermentation agent of bio-organic fertilizer after amplification and fermentation
2.8 生物有机肥发酵菌剂贮藏稳定性的测定
表10列出了生物有机肥发酵菌剂成品密封室温贮藏 30d后指标变化.贮藏后菌剂水解酶的酶活力发生了一定变化,CMC酶的酶活力由1247.3U/g提升至 1718.9U/g,主要由于贮藏时纤维素分解菌仍可利用菌剂基质中残留的营养物质代谢;
中性蛋白酶的酶活力显著下降,可能由于自然条件下酶活力水平存在一定损失;
有效活菌数随时间的延长有所下降,虽与贮藏前相比有显著性差异,但存活率达到了83.2%;
α-淀粉酶的酶活力、水分散性指标、除臭指标、有效活菌数之间差异不显著.贮藏30d的生物有机肥发酵菌剂成品指标也均符合国家标准 GB20287—2006《农用微生物菌剂》.

表10 生物有机肥发酵菌剂贮藏30d后指标变化Tab.10 Index changes of fermentation agent of bio-organic fertilizer after 30 days storage
2.9 生物有机肥发酵菌剂在豆粕堆肥中效果验证
国家农业行业标准 NY/T 525—2021《有机肥料》中规定腐熟有机肥技术指标要求:含水率≤30%、pH 5.5~8.5、有机质≥30%、总养分(TN+P2O5+K2O)≥4.0%、种子发芽指数(GI)≥70%.70% GI只能说明堆肥对作物抑制作用较小;
GI≥85%,才说明堆肥完全腐熟;
当 GI≥100%时,堆肥对作物无毒性[24];
腐熟完全的堆肥要求σ<9.0mS/cm、终点 C/N:初始C/N<0.6[25-26],此时对种子发芽无抑制作用.本研究以 GI≥85%、σ<9.0mS/cm、终点 C/N:初始 C/N<0.6为腐熟评判标准.
30℃发酵40d后豆粕堆肥指标测定结果见表11.添加生物有机肥发酵菌剂组(KJ)、强兴发酵菌剂组(QX)含水率显著低于对照组(CK).外源微生物代谢活跃促使堆肥温度升高,揭膜后加速了水分蒸发.堆肥发酵过程中,pH会呈现先下降后上升的趋势.在初始阶段,由于可利用的能量物质较多,微生物繁殖快,其代谢产生的有机酸使pH下降;
堆肥继续进行,有机酸随着温度升高而挥发,同时,有机氮向铵态氮类物质转化所产生的氨使pH又开始回升.堆肥有机质含量反映了有机物分解菌的分解能力,其产生的水解酶类加速了有机质的分解,可知KJ组和QX组中的分解菌在发酵过程中占据主导地位,CK组中原有微生物分解能力较弱,发酵后 KJ组的有机质最低,与CK组有显著性差异.

表11 40 d生物有机肥发酵菌剂豆粕堆肥评价表Tab.11 Evaluation table of soybean meal composting with 40 d fermentation agent of bio-organic fertilizer
从表11结果来看,添加菌剂可在一定程度上增加养分,菌剂中未添加根际促生菌,但起升温作用的微生物具备一定的养分分解释放的作用,KJ组的TN含量、P2O5含量、K2O 含量均最高,同 CK 组差异均显著.电导率反映堆肥浸提液中可溶性盐的含量,KJ组和 QX组在发酵后可显著降低堆肥的含盐量.KJ组终点C/N∶初始C/N的值最小,腐熟更为彻底.KJ组在发酵后种子发芽指数显著高于QX组和CK组,堆肥中有机酸等中间产物和NH3、H2S等毒性物质已被充分分解转化.以上 3种堆肥产品均达到 NY/T 525—2021《有机肥料》的要求.
以腐熟度指标电导率、终点 C/N:初始 C/N、种子发芽指数为最终评价指标,可得出腐熟度为 KJ组>QX组>CK组.这说明该生物有机肥发酵菌剂腐熟效果最优,加速了堆肥腐熟.同时,总养分结果表明,KJ组和QX组的菌剂提高了堆体品质.
本文依托复合功能菌发酵多元辅料研制成一种水分散性生物有机肥发酵菌剂,该发酵菌剂基质质量比为 麦 麸 :
稻 糠 :
豆粕=18:7:25,发酵条件为初始 pH 7.0、培养温度 30℃、培养时间 7d、接种量5%、含水率 40%,在发酵前添加 3% PEG6000和 5%吐温 80、烘干前添加 5%STPP和 5%(NH4)2SO4,经5L发酵罐放大后产CMC酶的酶活力为1247.3U/g,中性蛋白酶的酶活力为 216.5U/g,α-淀粉酶的酶活力为 21.9U/g,H2S去除率为 58.7%,NH3去除率为63.1%,有效活菌数为 7.86×109g-1,润湿时间为105.2s,悬浮率为 40.7%,分散次数为 7.3次,水分散用量为 0.99%,具有良好的贮藏稳定性.菌剂应用于豆粕堆肥中可加速腐熟,制备的生物有机肥堆体总养分(TN+P2O5+K2O)含量高达 5.54%,电导率为 2.67 mS/cm,终点 C/N:初始 C/N 为 0.34,GI高达143.15%,符合国家农业行业标准 NY/T 525—2021《有机肥料》的要求.所用固态发酵基质成分简单、价格低廉、培养时间短、产水解酶的酶活力高,将水分散体系应用于生物有机肥发酵菌剂开发,兼具制备方法简易、成本低廉、分散性较好等优点;
攻克了传统腐熟发酵菌剂发酵不充分、菌群单一、堆肥操作复杂等问题;
适合规模化生产,本工艺稍作优化还可应用于饲料添加剂,在农业生产中具有实际应用意义.