刘永杰,汤姜杨,朱丽丽,李洪林
(华东理工大学药学院, 上海市新药设计重点实验室, 上海 200237)
胞外5′-核苷酸酶(e5NT,又称CD73),由NT5E基因编码,蛋白分子量为70 kDa,被糖基磷脂酰肌醇(GPI)固定在细胞表面[1-3]。CD73 与CD39 共同参与嘌呤能信号的调控,在嘌呤能信号通路中,三磷酸腺苷(ATP)/二磷酸腺苷(ADP)被CD39 水解为单磷酸腺苷(AMP),AMP 被CD73 水解为腺苷和磷酸,AMP转化为腺苷在细胞外不可逆[4]。在肿瘤微环境中,CD73 的过表达与肿瘤细胞的免疫逃逸有关。CD73 在肿瘤细胞、树突状细胞(DCs)、调节性T (T reg)细胞、骨髓源性抑制细胞(MDSCs)、自然杀伤细胞(NK)和肿瘤相关巨噬细胞(TAMs)的细胞表面均有表达[5]。CD73 的表达受缺氧诱导因子-1 (HIF-1)、TGF-β、EGFR、AKT、β-catenin等分子的调控,特别是受HIF-1[6-10]的调控尤为突出。缺氧是肿瘤微环境的一个重要特征,缺氧诱导HIF-1 上调,进而导致肿瘤微环境中CD73 的广泛表达。放化疗引起的缺氧或ATP 富集会促进CD39-CD73-腺苷信号的级联反应,有利于增强肿瘤细胞的增殖和功能,促进肿瘤免疫逃逸[11]。因此,CD73 被认为是一个重要的肿瘤免疫治疗潜在靶点。
由于CD73 与肿瘤发生、发展以及扩散之间的关系,全球众多医药企业和科研单位都在积极开发靶向CD73 的单克隆抗体和小分子抑制剂。目前,代谢稳定的核苷酸类似物是CD73 小分子抑制剂研发的主流[12]。1970 年,核苷酸类似物AMPCP (抑制常数Ki=88.4 nmol/L)首次被报道具有强效的CD73 抑制活性[13]。文献[14-16]报道了活性更强的核酸类似物PSB-12379 (Ki=2.2 nmol/L)、PSB-12489 (Ki=0.31 nmol/L),处于临床研究中的CD73 抑制剂AB680 (Ki=5 pmol/L)也属于核酸类似物[17]。虽然这类化合物具有强效的CD73 抑制活性,但是由于酸性太大,影响其成药性。此外,一些非核苷酸类CD73抑制剂也被报道,主要包括黄酮类化合物[18]、磺胺类化合物[19]、蒽醌类化合物[20]和苯并噻嗪类化合物[21],但这些化合物表现出比较弱的活性或潜在的代谢问题。2020 年文献[22]报道了一类新型高活性、具有选择性的CD73非核苷酸抑制剂,这类化合物因避免了CD73 核苷类抑制剂酸度大、透膜性低等缺点,从而性能得以提高。
本文对实验室保存的876 个已经上市的药物开展靶向CD73 的筛选,发现顺苯磺酸阿曲库铵(51w89)可以抑制CD73 的酶活性,为研发CD73 小分子抑制剂提供了新的苗头化合物。
1.1 材料
1.1.1蛋白与细胞 CD73 蛋白由本实验室根据文献[2]纯化得到,MDA-MB-231、MCF-7、Wi-38 细胞来源于ATCC 细胞库。
1.1.2试剂 孔雀绿试剂盒购自BioAssaySystems(POMG-25H);
CD73siRNA 购自广州锐博生物科技有限公司(siG000004907A);
Lipo6000转染试剂购自Beyotime(C0526);
CD73 抗体(CD73RabbitPolyclonal antibody)购自Proteintech(12231-1-AP);
GAPDH 抗体(GAPDH Mouse mAb)购自Abclonal(AC002);
Goat-anti-MouseSecondaryantibody 购自SAB 抗体公司(L3032);
Goat-anti-RabbitSecondaryantibody 购自SAB 抗体公司(L3042);
氨基偶联试剂盒、醋酸钠缓冲液(pH4.5)和CM5 芯片购自GEHealthcare;
RIPA裂解液购自武汉塞维尔生物科技有限公司(G2002);
BCA(BicinchoninicAcidAssary)试剂盒购自BioSharp(BL521A);
BSA 购自源叶生物(9048-46-8);
结晶紫染色液购自Beyotime(C0121);
Matrigel 基质胶购自康宁公司(354248);
T 细胞扩增培养基购自Sigma 公司(S1694);
CD3/CD28 抗体购自Stemcell(10971);
IFN-γELISA检测试剂盒购自联科生物(EK180-48);
CD8+T 细胞磁珠分选试剂盒购自Biolegend(480011);
腺苷5′-(α,β-亚甲基)二磷酸APCP(CAS号:3768-14-7)、51w89(CAS 号:96946-42-8)以及AMP(CAS 号:130-49-4)购自Sigma 公司。
1.2 实验方法
1.2.1分子水平CD73 活性测试 将重组CD73 蛋白用测活缓冲液(1mmol/LCaCl2,1mmol/LMgCl2,200mmol/L NaCl,10mmol/LKCl,100mmol/LTris-HCl,pH=8.0)稀释至10ng/mL,在96 孔板中加入70μLCD73 蛋白稀释液,然后加入化合物二甲基亚砜(DMSO,体积分数控制在0.5%),吹打均匀后室温孵育10min,加入AMP 使其终浓度为15μmol/L,然后放至37℃烘箱中孵育30min 后,加入孔雀绿试剂置于室温显色30min,待颜色稳定后使用酶标仪(美国伯腾仪器有限公司,Synergy2)检测630nm 的吸光度值。每个实验条件设3 个复孔,使用GraphPadPrism7.0 软件拟合化合物的IC50值。
1.2.251w89 与CD73 蛋白结合亲和力的测定 采用表面等离子体共振(SurfacePlasmonResonance,SPR)技术测定化合物51w89 与CD73 蛋白之间的结合亲和力。SPR 实验是在Cytiva(思拓凡)公司的BIAcore T200 仪器上进行。首先将纯化后的CD73蛋白用pH 4.5 的醋酸钠溶液稀释至75 μg/mL,再用偶联试剂1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)将CD73 蛋白偶联在CM5 芯片上,流速为10 μL/min,结合时间为600 s,最后用乙醇胺封闭,最终CD73 偶联量约为4946 RU。偶联完成后,利用运行缓冲液(10 mmol/L 磷酸盐缓冲液(PBS),2.7 mmol/L KCl, 137 mmol/L NaCl 和φ=0.005%表面活性剂P20, pH 7.4)冲洗芯片表面直至基线平稳,之后将51w89 用运行缓冲液溶解,并且成倍稀释成一系列浓度梯度(1.563、3.125、6.250、12.500、25.000 μmol/L),以30 μL/min 的流速,结合90 s,解离120 s。实验结果利用BIAcore T200 Evaluation 1.0 软件进行稳态拟合。
1.2.3Westernblot 检测CD73 在肿瘤细胞中的表达选取两株人乳腺癌细胞(MDA-MB-231、MCF-7)以及一株人胚肺细胞(Wi-38)以每毫升5×104个细胞的密度铺于6 孔板中,待密度和活力均达到90%以上时,用PBS 刮取清洗细胞并于放射免疫沉淀法(RIPA)裂解液中孵育30min,离心去上清,用BCA试剂盒测定蛋白浓度。样品与5×loading 上样缓冲液混匀,在100℃金属浴中煮5min,接着对其进行10%SDS-PAGE 凝胶电泳并转膜,将目的条带剪下用5%BSA封闭1h 后,用CD73 抗体孵育并置于4℃过夜。用含TBST 缓冲液(Tris-HCl,NaCl,Tween 20)清洗3 遍,于室温下孵育二抗2h,随后用化学发光仪曝光条带。
1.2.4细胞水平CD73 活性测试 当MDA-MB-231 的细胞密度达到90%、细胞活力达到95%及以上时,加入胰酶消化,将细胞悬液转移至15mL无菌离心管中,在1000r/min 转速下离心3min,弃去培养基,加入活性测试液(2mmol/LMgCl2,125mmol/LNaCl,1mmol/L KCl,10mmol/L葡萄糖,10mmol/L4-羟乙基哌嗪乙磺酸(Hepes)缓冲液,pH7.2)重悬细胞,然后在1000r/min转速下离心3min,重复上述操作3 次。细胞计数后,用活性测试液稀释细胞,在96 孔板中每孔加入70μL(约2500 个细胞)细胞悬液,然后加入化合物吹打均匀(DMSO 的体积分数控制在0.5%),置于37℃烘箱中孵育10min,加入底物AMP 使其终浓度为15μmol/L,然后加入孔雀绿试剂室温显色30min,待颜色稳定后使用BioTek 酶标仪检测630nm 处的吸光度值。每个实验条件下设3 个复孔,使用GraphPadPrism7.0软件拟合化合物的IC50值。
1.2.5siRNA 干扰肿瘤细胞CD73 表达 将生长状态良好的MDA-MB-231 消化后重悬,以每孔1×105个的细胞密度均匀铺于6 孔板中,待6 孔板中的细胞生长融汇达50%以后,将CD73 siRNA 通过Lipo6000转染到MDA-MB-231 细胞中,继续培养3 d 后,通过Western blot 检测CD73 表达情况。
1.2.6Transwell 实验 设置空白组、阴性对照组(CD73-siRNA 组,敲除了CD73 的MDA-MB-231 细胞)以及加药组(10μmol/L51w89),在Transwell 上室加入100μL 与上述对应的细胞及化合物,细胞密度为每毫升5×104个细胞,同时在下室加入φ=10%的胎牛血清培养基600μL。孵育24h 后,丢弃上室细胞,通过膜向下表面迁移的细胞用甲醇室温固定15min,结晶紫染色15min,然后用PBS 清洗上室3遍。将小室放在载玻片上,选取至少3 个不同的视野,在显微镜(德国Leica 公司,LeicaDMil 型)下观察并拍照。
1.2.7细胞划痕实验 将生长状态良好的细胞MDAMB-231 正常消化后重悬,以每孔5×105个的细胞密度均匀铺于6 孔板中,设置对照组、51w89 组(51w89浓度分别为5、10、50μmol/L),然后将细胞转移到培养箱中继续培养。待6 孔板中的细胞生长融汇达到95%后,用10μL 的移液器吸头垂直于底部划痕,然后弃去原来的培养基,用PBS 漂洗3 次,洗去漂浮的细胞碎片。用无血清RMPI-1640 培养基将51w89依次稀释为50、10、5μmol/L,并加入到相应的孔中,对照孔中只加入无血清的RMPI-1640 培养基。划痕0、12、24、36h 后,选取至少3 个不同的视野,在显微镜下观察并拍照。
1.2.8ELISA 法检测T 细胞中IFN-γ的分泌水平收集健康志愿者的外周血,用磁珠分选试剂盒分出CD8+T 细胞,将CD8+T 细胞在完全生长培养基(1 mmol/L 谷氨酰胺,30 IU/mL IL-2 和25 μL/mL的CD3/CD28T 细胞激活剂)中培养24h,然后收集细胞,重悬在不含T 细胞激活剂的细胞扩增培养基中。将细胞以每孔8×104个细胞(90 μL)接种于96 孔板上,加入待测化合物,以1 μmol/L 腺苷5"-(α,β-亚甲基)二磷酸(APCP)作为对照,于37 ℃孵育15 min 后,除了空白对照组外均加入终浓度为25 μmol/L的 AMP,在37 ℃,φ=5% CO2条件下孵育96 h。每个实验条件设3 个复孔。将96 孔板于300g条件下离心10 min,取上清,用ELISA 法检测细胞因子含量。
2.1 51w89 抑制重组蛋白CD73 的酶活性
以100 μmol/L 的化合物浓度对本课题组的老药库(包含876 个已经上市的药物)进行初筛,可得到100 μmol/L 51w89 对重组蛋白CD73 的抑制率为93.30% (图1(a)中红色球),然后设置不同浓度的51w89 测试其对CD73 的抑制活性,测得其分子水平的IC50为(13.30±0.34) μmol/L(图1(b))。

图1 51w89 抑制重组蛋白CD73 的酶活性Fig.1 Inhibition activity of 51w89 against recombinant CD73
2.2 SPR 评价51w89 与重组蛋白CD73 的结合亲和力
为了进一步验证51w89 靶向结合CD73,采用SPR 技术评价51w89 与重组蛋白CD73 的结合亲和力,得到其结合亲和力系数(KD)为20.45 μmol/L(图2)。
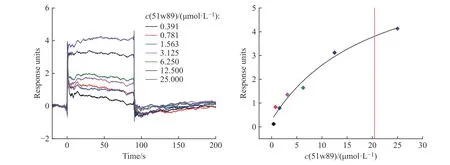
图2 51w89 与重组CD73 蛋白结合的SPR 结果Fig.2 SPR results for the binding affinity between 51w89 and CD73
2.3 51w89 抑制人乳腺癌细胞MDA-MB-231 中CD73 的酶活性
51w89 对人乳腺癌细胞MDA-MB-231 的细胞毒性小(IC50= (71.43±1.19)μmol/L),且高表达CD73(图3(a)),因此本文选择MDA-MB-231 细胞用于后续细胞实验。用孔雀绿试剂盒测试在MDA-MB-231 细胞中51w89 对CD73 的酶抑制活性,得到IC50为(17.70±0.98)μmol/L(图3(b))。
2.4 Transwell 实验测试51w89 抑制MDA-MB-231细胞的迁移能力
将CD73 siRNA 转染到MDA-MB-231 细胞(即CD73-SiRNA 中后,通过Western blot 分析CD73 表达情况(图4(a)),结果表明转染CD73 siRNA 后,CD73 的表达量明显降低。Transwell 实验结果显示,加入51w89 或siRNA下调CD73 表达后,穿膜细胞数少于对照组,即抑制了MDA-MB-231 细胞的迁移(图4(b))。

图4 51w89 或CD73-siRNA 对MDA-MB-231 细胞迁移能力的抑制效果Fig.4 Inhibitory effects of 51w89 or CD73-siRNA on the migration of MDA-MB-231 cells
2.5 划痕实验显示51w89 抑制MDA-MB-231 细胞的迁移能力
划痕实验结果如图5 所示,在没有添加51w89的情况下(控制组),从0~36 h,划痕随着时间在逐渐修复,说明MDA-MB-231 细胞进行了迁移;
而添加51w89的处理组,细胞的愈合能力较对照组减弱,而且随着51w89浓度的增加,划痕的愈合面积随之减小,说明MDA-MB-231 细胞的迁移能力也逐渐受到抑制。该实验结果表明51w89 抑制MDA-MB-231细胞的迁移活性。

图5 51w89 抑制MDA-MB-231 细胞迁移的划痕实验Fig.5 Inhibitory effects of 51w89 on the migration of MDA-MB-231 cells by scratch tests
2.6 51w89 可以逆转AMP 对CD8+T 细胞的抑制作用
腺苷信号传导与免疫调节息息相关,腺苷浓度过高时会产生免疫抑制。AMP 可被CD73 水解为腺苷和磷酸,因此CD73 是腺苷产生过程中的限速分子。加入25 μmol/L 的 AMP 后,CD8+T 细胞分泌的炎症细胞因子IFN-γ水平降低,而CD73 抑制剂APCP或51w89 可在一定程度上逆转AMP 对CD8+T 细胞分泌IFN-γ的抑制作用(图6)。
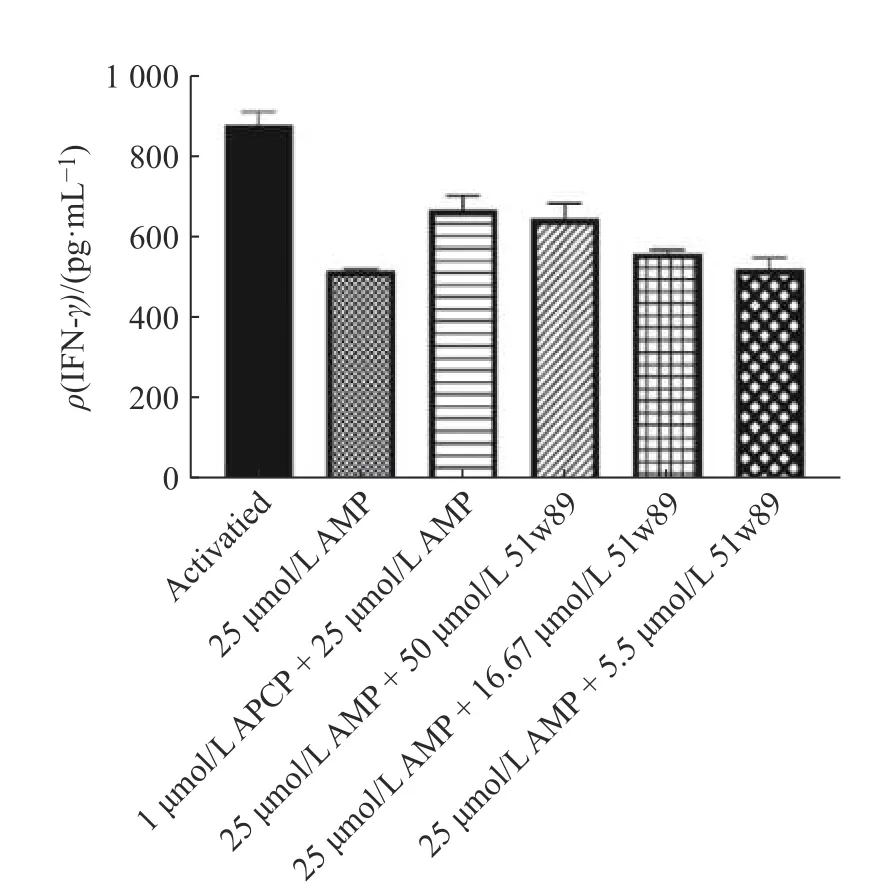
图6 ELISA 法测定CD8+T 细胞分泌IFN-γ 的水平Fig.6 Measurements of IFN-γ secretion in CD8+T cells by ELISA
在肿瘤微环境中,腺苷是ATP 的代谢产物,是一种有效的免疫调节因子。CD73 在肿瘤细胞和免疫细胞上的过表达导致肿瘤微环境中腺苷的浓度升高,高浓度的腺苷抑制抗肿瘤免疫反应,促进肿瘤细胞增殖、转移和血管生成。CD73 是腺苷生成过程中的限速分子,因此,抗CD73 治疗有望成为一种新的肿瘤免疫治疗方法。
本文筛选发现51w89 对CD73 具有酶抑制活性,通过表面等离子体共振实验验证51w89 可靶向结合CD73。通过划痕实验、Transwell 实验和siRNA实验证明CD73 在肿瘤细胞迁移过程中的作用,表明51w89 可抑制MDA-MB-231 细胞的迁移能力。另外,证实51w89 可逆转AMP 对CD8+T 细胞的抑制作用。因此,51w89 可被作为CD73 抑制剂苗头化合物并用于后续的结构优化以及抗肿瘤研究。
猜你喜欢孔板腺苷划痕核电厂高压安注系统再循环管线节流孔板的分析与改进核科学与工程(2022年3期)2022-10-18为什么越喝咖啡越困检察风云(2022年5期)2022-04-05富马酸卢帕他定治疗皮肤划痕症的疗效观察皮肤病与性病(2021年3期)2021-07-30限流孔板的计算与应用广州化工(2020年6期)2020-04-18长距离矿浆管道系统中消能孔板的运行优化现代矿业(2018年9期)2018-10-16冰上芭蕾等学生天地·小学低年级版(2017年12期)2018-04-16环磷腺苷葡胺治疗慢性充血性心力衰竭临床研究国外医药(抗生素分册)(2016年3期)2016-07-12犀利的眼神初中生学习·高(2016年10期)2016-05-30α-硫辛酸联合腺苷钴胺治疗糖尿病周围神经病变效果观察山东医药(2015年16期)2016-01-12光滑表面浅划痕对光反射特性物理实验(2015年10期)2015-02-28